2020年張強教授團隊在靶向遞藥領域獲系列進展
2020年張強教授課題組連續在抗腫瘤靶向遞送研究領域取得重要成果,目前已在Advanced Functional Materials(IF="16.836)🩰、Journal of Extracellular Vesicles(IF="14.976)、Biomaterials(IF="10.317)等國際權威學術雜誌上發表了一系列研究文章。簡要回顧如下:
1. 微波合成的納米共價有機聚合物用於增強光動力治療
2020年9月9日,國際著名學術期刊《先進功能材料》(Advanced Functional Materials)在線發表了我院藥劑學系張強課題組在抗腫瘤藥物靶向遞送領域的最新研究成果“Strengthened Tumor Photodynamic Therapy Based on a Visible Nanoscale Covalent Organic Polymer Engineered by Microwave Assisted Synthesis”🌍。

近年來,共價有機骨架(COFs)和共價有機聚合物(COPs)由於其較大的表面積、可調的孔徑、良好的穩定性和生物可降解性,從而備受關註。本研究采用微波合成法將納米級COPs的製備時間縮短至20分鐘,並構建了包載硫氧還蛋白(Trx-1)抑製劑的藥物遞送系統(nCOP-PX-12)協同四氨苯基卟啉(TAPP)實現乏氧腫瘤的光動力治療(PDT)🦋。該“可見”納米粒被腫瘤細胞攝取並最終進入溶酶體後,C="N連接鍵會在酸性pH下斷裂,釋放出遊離的TAPP和PX-12。TAPP可以靶向至線粒體,在激光照射下生成活性氧(ROS);同時,PX-12抑製Trx-1使ROS的相對含量增加,誘導腫瘤細胞發生更強烈的免疫原性死亡並刺激抗原提呈細胞的成熟。此外,PX-12能夠進一步阻斷Trx-1的下遊信號通路如HIF-1α和VEGF等,從而影響腫瘤的增殖和轉移。在激光照射下,nCOP-PX-12在4T1小鼠模型中展示出顯著的抗腫瘤效應,可以有效抑製原位腫瘤🦙、遠端腫瘤和肺部轉移✋。該研究為納米級COPs開發了快速高效的製備方法,展示了其在藥物遞送應用中的廣闊前景,並提出了聯合Trx-1抑製的策略來攻克缺氧腫瘤對傳統PDT的抵抗性。

這項工作得到了國家重點研發計劃和國家科學基金的支持🧑🧒。藥學院2017級直博生陸遙為論文第一作者,張強教授和代文兵副教授為共同通訊作者。
原文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202004834
2. 基於細胞外囊泡的抗癌納米藥物的“吃我/別吃我”組合策略
2020年8月19日,國際著名學術期刊《外泌體雜誌》(Journal of Extracellular Vesicles)在線發表了我院藥劑學系張強課題組在抗腫瘤藥物靶向遞送領域的最新研究成果“A combined “eat me/don’t eat me” strategy based on extracellular vesicles for anticancer nanomedicine”。

納米藥物面臨的一個長期和巨大的挑戰是由單核吞噬細胞系統(MPS)介導的對其大量攝取和快速清除,這極大地阻礙了納米藥物的發展。該研究構建了“eat me / don’t eat me” 聯合策略,以實現MPS逃逸和高效藥物遞送👲。方法上,使用源自DC2.4細胞的陽離子化甘露聚糖修飾的胞外囊泡飽和MPS (eat me)👩🏿🚒。然後,納米載體與來自人血清的富含CD47的外泌體融合,以逃避MPS的吞噬作用(don 't eat me)。納米載體還裝載抗腫瘤藥物,並與之前使用的歸巢肽(c(RGDm7))結合,以促進腫瘤組織聚集和癌細胞攝取(eat me)。這一概念在體外得到證實,巨噬細胞的內吞作用減少,腫瘤細胞攝取增強,而在體內循環時間延長,腫瘤累積增加。特別是,與傳統的納米載體相比,該策略增加了在腫瘤組織的分布。這項研究不僅揭示了克服吞噬逃逸的挑戰,而且為顯著改善治療效果提供了一種策略,有助於實現通過靶向納米藥物進行主動藥物遞送🌧。

意昂2平台藥學院天然藥物及仿生藥物國家重點實驗室的王靜博士為本文的表面等離振子共振實驗提供了幫助👨🏿🏫。藥學院博士後紮琪亞為論文第一作者,張強教授和代文兵副教授為共同通訊作者。
原文鏈接:https://www.tandfonline.com/doi/full/10.1080/20013078.2020.1806444
3. 負載siRNA納米盤上的各向異性配體通過調節納米-生物互作產生獨特抑癌作用
2020年4月3日,國際著名學術期刊《生物材料》(Biomaterials)在線發表了我院藥劑學系張強課題組在抗腫瘤藥物靶向遞送領域的最新研究成果“Anisotropic active ligandations in siRNA-Loaded hybrid nanodiscs lead to distinct carcinostatic outcomes by regulating nano-bio interactions”。

主動靶向是提高納米藥物的遞送效率和治療功效的最重要策略之一。目前仍不了解各向異性配體修飾如何影響納米-生物相互作用以及納米藥物的治療效果。為了揭示各向異性配體修飾對納米藥物傳遞作用機製的影響,本研究製備了一系列陽離子納米盤(NDs),並對其邊緣(E)或平面(P)進行cRGD修飾,獲得了各向異性靶向納米盤(分別記為E-cRGD-NDs和P-cRGD-NDs)並闡明了兩種各向異性靶向NDs之間的區別、相似性和作用機製🧑🏼🔧。研究發現E-cRGD-NDs在siRNA負載🏠⬅️、細胞攝取、沉默效率🧑🏻⚖️🫵🏻、蛋白表達甚至體內效應等方面顯示出明顯的優勢,這些差異和相似性與配體修飾的各向異性密切相關。同時,cRGD有效地分離了靶向區域和siRNA負載域,從而最大限度地發揮了各自的功能。此外,由於表面包裹了矽氧矽網格結構,新型靶向雜化陽離子納米盤非常穩定,在體內外藥物遞送和治療中顯示了明顯的優勢🧙🏼👨🏻💼。這些發現反映了配體各向異性的獨特作用,也為廣泛篩選靶向納米藥物提供了新的策略👨。
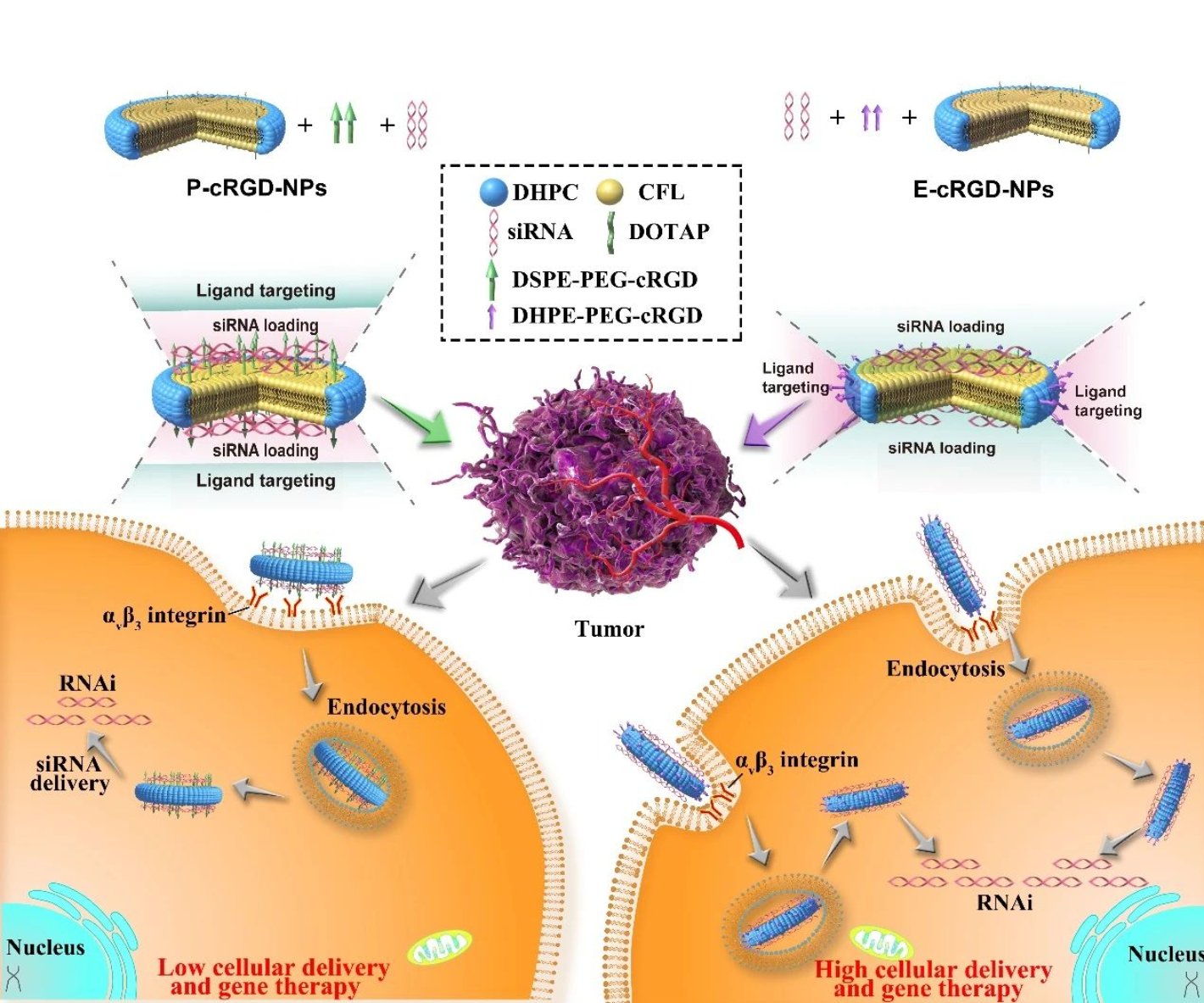
這項工作得到了國家基礎研究計劃、國家重點研發計劃和國家自然科學基金的支持🔱。藥學院2016級博士生陳晴為論文第一作者,意昂2平台藥學院何冰、張強以及沈陽藥科大學陳大為共同通訊作者。
原文鏈接:https://doi.org/10.1016/j.biomaterials.2020.120008
【作者簡介】

意昂2平台藥學院張強教授系意昂2平台特聘教授,分子藥劑學與釋藥系統北京市重點實驗室主任,教育部創新團隊負責人,中國藥學會(CPA)常務理事,中國藥學會納米藥物專業委員會副主任委員,國家藥典委藥製專業委員會副主任,《藥學學報B》副主編,《J Control Release》編委等。作為CRS中國分會的首任主席,長期從事納米藥物研究,在Nature Communications,Advanced Functional Materials、ACS Nano、Nano Letters、Advanced Drug Delivery Review, Biomaterials, J Control Release等發表300多篇SCI論文。負責完成創新製劑研究30余項,申請國內外發明專利50多項,開發上市多個新型釋藥系統,產生重大經濟與社會效益💃。獲國家與省部級科技成果獎多項。
(藥學院藥劑學系)
編輯:玉潔


