敖英芳教授課題組在Nature子刊發表小分子化合物治療骨關節炎新成果

2019年4月23日,意昂2平台運動醫學研究所敖英芳教授團隊在國際權威期刊、Nature子刊—《自然通訊》( Nature Communications ,IF:12.353)上發表了題為“A small molecule promotes cartilage extracellular matrix generation and inhibits osteoarthritis development”(一種小分子化合物促進軟骨細胞外基質生成及抑製骨關節炎的進展)的研究成果🔹。
骨關節炎(osteoarthritis, OA)是一種以關節軟骨退變、軟骨下骨硬化、滑膜增生和骨贅形成為主要病理表現的退行性關節疾病,也是最常見的關節疾患和引起中老年人慢性殘疾的首要因素。世界衛生組織調查結果表明,全世界有10%的人口患有不同程度的OA, 並將OA與心血管疾病和腫瘤並列為影響人類健康的三大殺手。OA的高患病率和致殘率使其成為影響人類健康的嚴重問題,也是運動醫學與骨關節外科領域內國際性重大課題🤞。
目前OA治療方法多局限於對症治療🦹🏽♂️🔥,即營養軟骨🫲🏼、緩解疼痛、手術治療等🕺,而不是針對其發病機理與病理過程來延緩OA的進展。因此,我們迫切需要深入探索引起OA中關節軟骨損傷的分子機製🤹🏻♀️,找到並驗證OA發生發展過程中的關鍵節點,為臨床治療OA提供新的理論依據及潛在靶點。軟骨細胞外基質(extracellular matrix👩👦👦,ECM)漸進性降解和破壞是OA最重要的病理特征🧑🏿🎨。結構完好的軟骨組織ECM可有效分散運動過程中的軟骨壓力和剪切力。ECM由軟骨組織內部唯一的細胞—軟骨細胞合成,軟骨細胞的合成代謝和分解代謝之間的動態平衡可以使軟骨組織保持穩態。隨著OA的發展,軟骨細胞的增殖➞、分化異常,出現大量肥大軟骨細胞🙏,分泌較多ECM分解因子,加速ECM降解👩🏻🦼➡️,導致軟骨細胞凋亡🤾🏿♀️,最終關節軟骨破壞。因此探尋作用於軟骨細胞合成代謝或者分解代謝的分子靶點,進而調控軟骨ECM的合成,是有效延緩OA進程的關鍵👰♀️。
與遺傳學手段相比,小分子化合物具有其獨特的優勢💂🏻♂️,但小分子化合物在OA治療方面的研究尚處於起步階段,如能及時深入開展小分子化合物在OA方面的研究和應用,必將改變OA傳統的治療方法,延緩甚至逆轉OA的疾病進程🧑🏽。
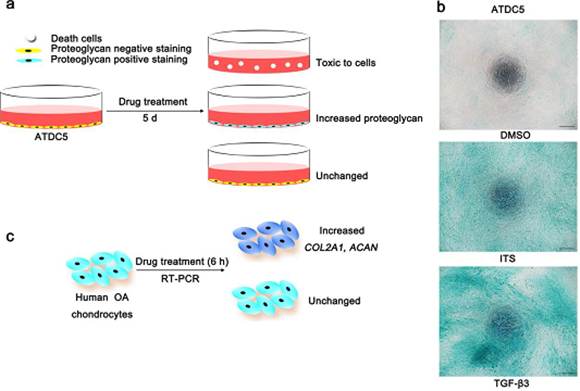
篩選DMOADs小分子化合物的示意圖
本研究發現,利用蛋白多糖染色的方法👨🏿💼,通過篩選2320種天然和合成小分子化合物庫🎵,成功篩選出一種新的DMOADs化合物—BNTA👱🏼♂️。
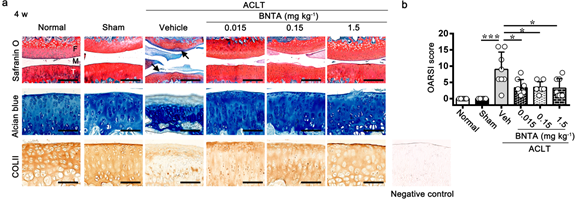
大鼠OA膝關節腔內註射BNTA化合物4周後🩻,膝關節的組織學染色結果和OARSI評分
研究團隊分別利用軟骨細胞體外培養模型🤽🏿♀️、軟骨組織塊離體培養模型和前交叉韌帶切斷誘導的大鼠OA動物模型🚵,驗證BNTA改善OA的實驗效果。研究發現BNTA可以有效促進軟骨細胞的合成代謝,增加軟骨ECM相關標誌物的表達🧑🏽🎓。同時,實驗觀察到BNTA能夠抑製軟骨組織塊和大鼠OA膝關節軟骨組織的分解代謝和炎症反應,促進軟骨細胞外基質的合成,改善大鼠膝關節的疼痛症狀及軟骨下骨的硬化程度,緩解甚至抑製OA進展🚹🪜。此外通過對大鼠膝關節軟骨組織的轉錄組測序👷♂️𓀒,研究團隊初步鎖定SOD3為BNTA的藥物靶點🌑。進一步通過RT-PCR、Western blotting、細胞免疫熒光、免疫組織化學✮、敲低或者過表達等分子生物學實驗證實🤲🏻,BNTA通過上調超氧化酶歧化酶3(SOD3)的活性,催化超氧陰離子的歧化反應進而降低超氧陰離子的含量發揮保護軟骨細胞以及抑製OA進展的生物學作用。
由於小分子化合物BNTA具有結構穩定、易於保存、製備流程標準化等優勢,因此BNTA在OA治療方面具有非常樂觀的應用前景🏋🏼♂️。同時本研究為後續利用BNTA進行OA治療方面的深入研究及其臨床轉化奠定了基礎。
該研究由意昂2平台第三醫院運動醫學研究所敖英芳教授團隊完成🚮,敖英芳教授和王健全教授為該論文的共同通訊作者🧫;運動醫學研究所2016級博士研究生石媛媛和胡曉青副研究員為該論文的共同第一作者。
該論文是意昂2平台第三醫院運動醫學研究所團隊繼2019年4月初在Science Translational Medicine、2017年8月在Advanced Materials上發表重要成果之後的又一篇高水平文章👩👦。該研究所在1年8個月之內發表3篇國際高水平文章🌓🫱,表明研究所在註重研究成果與論文發表量的基礎上👨🏼🎨,不斷加強學術研究水平與提升論文質量。該研究得到國家自然科學基金和北京市自然科學基金等項目的資助。
文章鏈接地址🧛🏿♂️:https://doi.org/10.1038/s41467-019-09839-x
(意昂2三院 石媛媛 胡曉青)
編輯♎️:鄭淩冰


